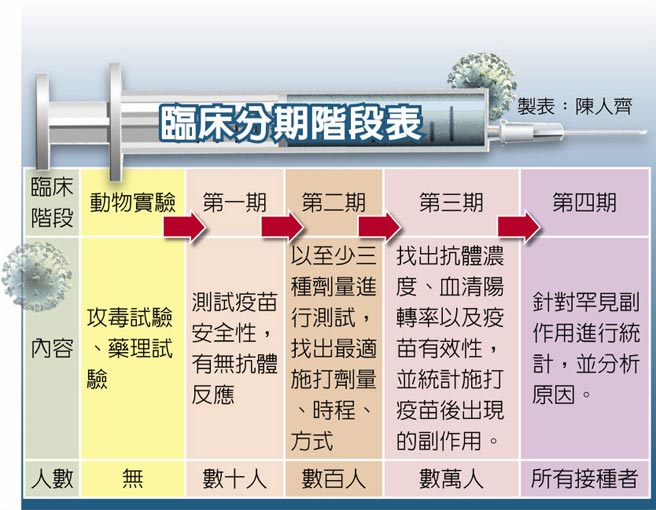
国产疫苗未完成二期临床试验,为何指挥中心就签约购买?指挥中心昨在记者会上有备而来,拿出手板指目前无论是AZ、莫德纳、BNT,通通都没完成第三期临床试验,且一、二期受试人数远小于国产疫苗,因此给国产疫苗「紧急使用授权(EUA)」也没有问题。政大副教授刘宏恩痛批指挥中心大玩话术又不诚实,民眾对政府的信任愈来愈动摇。
二期临床人数比国外多
指挥官陈时中表示,先签约是为提供厂商有足够动机量产与研发,并让国人能第一时间用到疫苗。他指出,BNT疫苗预估2023年4月才完成第三期临床试验,莫德纳2022年10月完成三期临床,但WHO、美国、加拿大、英国、日本各自在去年12月至今年2月间,以及今年5月前核准;AZ也是相同情形。
陈时中强调,2家国产疫苗二期临床试验已收超过3800人,远高于AZ、莫德纳、BNT获EUA前仅数百人的二期临床人数,因此只要最终数据合格,应该没有太大问题。
毋需做完 误导为不用做
不过,身兼疾管署人体研究伦理审查会委员的政大法律科技整合所副教授刘宏恩昨在脸书发文:什么是话术?把「临床试验毋需第3期完全做完」讲成「临床试验毋需进行到第3期」,就叫做话术;什么是诚实?明明并非比照美国食品药物管理局(FDA)国际标准来审查国产疫苗紧急许可,那就明白承认自己的标准比较宽松,不可以说自己的标准跟他们同样严格,否则就是不诚实。
依FDA标准 台湾较宽松
刘宏恩指出,美国FDA公告的新冠疫苗紧急授权许可申请标准,第4页明白要求,申请厂商须提供临床试验第三期得出清楚明确的有效性与安全性数据,才可能获得许可。BNT疫苗有临床试验第三期4.4万人受试数据;莫德纳有第三期约3万人、娇生有第三期约4.4万人、AZ也有第三期约2.4万人受试数据,才各获得美国FDA及欧盟同意其申请。
他说,去年10月卫福部食药署一公告「国产疫苗紧急授权许可只需要做临床试验第二期,且受试者只需3000人以上」,他就非常担忧,认为一定会引发争议,所以请政府务必清楚、公开说理与公共政策论辩,为何採取比欧美宽松的标准?7个多月过去了,民眾对政府的信任愈来愈动摇,如今政策沟通与修正调整的时机早已错过,只能被口水淹没。

发表意见
中时新闻网对留言系统使用者发布的文字、图片或檔案保有片面修改或移除的权利。当使用者使用本网站留言服务时,表示已详细阅读并完全了解,且同意配合下述规定:
违反上述规定者,中时新闻网有权删除留言,或者直接封锁帐号!请使用者在发言前,务必先阅读留言板规则,谢谢配合。