搜寻结果
以下是含有一期临床试验的搜寻结果,共151笔
-
《兴柜股》莹硕未来5年目标 新增85张药证
专业药物传输技术开发商莹硕(6677)总经理顏麟权表示,近年透过与国内外药厂结盟拓展全球市场陆续开花结果,昨日最新公布确定再取得4张药证,合计今年迄今国内取得10张药证,随着新品上市销售,下半年营运拚转盈,明年将启动IPO规划,未来5年将以全球取证85张以上,其中至少1项新剂型新药授权全球市场为目标。
-
生技业加速新药开发、临床取证
光辉10月台湾生技产业新药开发、国际药证布局纷纷驶入快车道,从血液肿瘤、罕见疾病到AI生成新药,药华药(6446)、泰合(6467)、仁新(6696)、安基生技(7754)等多家业者陆续推进全球临床与取证进程,显示台湾创新药研发正加速迈向国际市场。
-
太景小儿新药 拚三期临床
太景*-KY(4157)公告,接获中国大陆合作伙伴健康元药业集团通知,流感抗病毒新药Pixavir marboxil(TG-1000)小儿剂型通过国家药品监督管理局(NMPA)药品审评中心审查,可免除临床二期试验,直接开展三期临床试验,进行疗效及安全性试验。太景*董事长黄国龙表示,Pixavir口服悬液剂型三期临床试验以冬季完成收案、明年完成临床试验为目标,为最终药品上市申请,提供完整佐证数据。
-
《生医股》太景流感新药获中国核准 启动小儿临床三期试验
新药研发公司太景*-KY(4157)接获中国大陆合作伙伴健康元药业集团通知,流感抗病毒新药Pixavir marboxil(TG-1000)小儿剂型已通过国家药品监督管理局(NMPA)药品审评中心(CDE)审查,可免除临床二期试验,直接开展三期临床试验,进行疗效及安全性试验。
-
太景流感新药获准大陆启动小儿临床三期试验
太景*-KY(4157)公告,接获中国大陆合作伙伴健康元药业集团通知,流感抗病毒新药Pixavir marboxil (TG-1000)小儿剂型已通过国家药品监督管理局(NMPA)药品审评中心(CDE)审查,可免除临床二期试验,直接开展三期临床试验,进行疗效及安全性试验。
-
《生医股》国邑*L608登美国风湿学会 首款居家治疗SSc-DU新药亮相
国邑*(6875)自主开发的吸入新药L608(微脂体-伊洛前列素)在2025年美国风湿学会年会(ACR 2025)上发表一期临床试验成果。本次数据不仅佐证了L608具备良好的安全性和耐受性,更重要的是,在关键的药物动力学(PK)指标上展现出突破性优势,为美国尚无核准疗法的系统性硬化症相关肢端溃疡(SSc-DU)市场开启先发契机。
-
宇越生医 积极迈向公发兴柜
新药开发公司宇越生医宣布,其自主开发之CAR-T细胞治疗药物Welgenaleucel(UWC19)完成治疗淋巴瘤第一期临床试验。为推进后续临床二期试验,宇越生医近期已完成新一轮资金募集,由台安生技领投,并获经济部产业发展署代管的国发基金加入,以及多家生技创投共同参与。
-
《生医股》ERS年会 逸达发表MMP-12抑制剂FP-020二期临床设计摘要
逸达(6576)口服MMP-12抑制剂Linvemastat(FP-020)于中重度气喘患者的二期临床试验syMMPonia设计摘要,已获接受并将于2025年欧洲呼吸学会(ERS)年会,以口头发表形式进行。
-
《兴柜股》跨足505(b)(2)报捷 莹硕生技思觉失调新药申请美一期临床
莹硕(6677)治疗思觉失调症新药AX251已向美国食品药物管理局(FDA)提交一期临床试验申请(IND),由于美国採取默许方式(silence approval),自FDA受理申请的30日内若未收到任何补件议题,即审查通过,可径行执行临床试验。一旦AX251通过审查将代表莹硕成功进军新药领域,且首款新药瞄准成长快速的常见现代文明病,抢攻全球逾百亿美元商机。
-
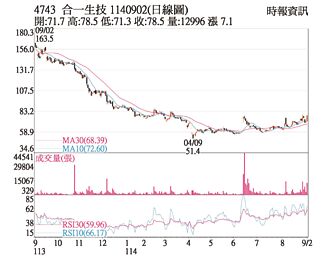
热门股-合一 KD指标交叉向上
合一(4743)受惠减重核酸新药SNS851併用全球热销的GLP-1减重药,可再增加四成减重效果,且停药后復胖率仅有GLP-1的一半,是目前全球减重药已公布的临床前最佳数据,预计今年第四季在澳洲执行一期临床试验消息面激励,2日股价直奔涨停价78.5元,顺势突破均线,KD指标也交叉向上,成交量加温至1.29万张。
-
《生医股》浩鼎启动OBI-902一期临床 治疗晚期实体肿瘤
浩鼎(4174)已启动OBI-902的一期临床试验。OBI-902为标靶TROP2的抗体药物复合体(Antibody-Drug Conjugate, ADC),该抗原在多种肿瘤细胞中高度表现。OBI-902亦是浩鼎首款採用醣偶联ADC技术的产品。
-
浩鼎抗癌新药OBI-902 启动一期临床试验
浩鼎(4174)31日宣布,已启动OBI-902的一期临床试验。OBI-902为标靶TROP2的抗体药物复合体(Antibody-Drug Conjugate,ADC),该抗原在多种肿瘤细胞中高度表现。OBI-902亦是浩鼎首款採用醣偶联ADC技术的产品。
-
合一 Q4启动临床试验
合一(4743)新药再添生力军,与全球热销的GLP-1减重药相比,合一减重核酸新药SNS851併用后可再增加四成减重效果,停药后復胖率仅有GLP-1的一半,是目前全球减重药已公布的临床前最佳数据,今年第四季在澳洲执行一期临床试验,同时展开与国际药厂洽谈合作,推动产品国际商化。
-
拚年底前登兴柜 三福生医前进资本市场
三福化(4755)除持续强化电子、特化升级耕耘,转投资生技事业也开展,三福生医目前已敲定针对治疗骨髓、青光眼、脑癌与卵巢癌的三种新药,进入不同程度临床及动物实验,今年持稳推进,目标下半年完成公发、年底前进入兴柜市场。
-
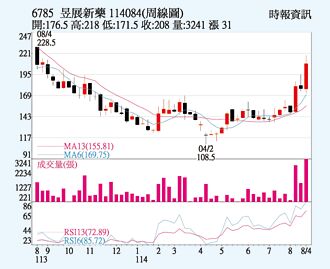
昱展 新药拓市报捷
昱展(6785)受惠授权伙伴Indivior将资源聚焦在戒毒瘾药物NDV-60001(ALA-1000),已在10个收案中心启动多重剂量药物动力学的收案,明年正式启动三期临床试验,8月以来吸引买盘进驻,22日以208元作收,上涨3.48%,成交量1,106张。技术面均线、KD指标均为多头排列,后市有利。
-
台塑生医 CDMO再传捷报
台塑生医加速拓展委托开发暨制造服务(CDMO)商业合作版图,继日前宣布与日本乐敦制药签署策略伙伴协议,20日宣告将与宇越生医以其研发的anti-CD19 CAR-T细胞治疗产品UWC19展开CDMO新业务,共同推动新一代CAR-T细胞治疗药物的临床及商业化生产。
-
《科技》台塑生医携手宇越生医 打造CAR-T细胞药物商业生产模式
台塑生医与宇越生医正式宣布策略合作,共同推动新一代CAR-T细胞治疗药物的临床及商业化生产。
-
《生医股》华安巴金森氏症新药一期临床试验达标 将申请美二期临床
华安(6657)自主开发治疗巴金森氏症口服新药ENERGI-F705PD,取得一期临床试验结果,显示具有良好的安全性与耐受性,并且初步证实可提高细胞内ATP能量。华安正加速准备提交美国二期临床试验相关申请书件,目标希望今年底前开展ENERGI-F705PD治疗巴金森氏症的二期临床试验。
-
华安新药达标 将申请二期临床
华安医学(6657)公告,自主开发治疗巴金森氏症口服新药ENERGI-F705PD,取得一期临床试验结果,显示具有良好的安全性与耐受性,并且初步证实可提高细胞内ATP能量。华安正加速准备提交美国二期临床试验相关申请书件,目标今年底前开展二期临床试验。 华安表示,ENERGI-F705
-
携手友杏生技 醣联拚加速临床试验
醣联21日宣布,GNX1021抗体药物复合体(ADC)携手友杏生技,顺利完成临床试验用药之预充填测试,规划2026年第一季向台湾及日本主管机关提出临床试验申请,同年第二季启动第一期临床试验。