據大陸國家藥監局網站消息,昨天(3月1日)大陸國家藥品監督管理局附條件批准安徽智飛龍科馬生物製藥有限公司的重組新型冠狀病毒蛋白疫苗(CHO細胞)上市註冊申請。該疫苗是首個獲批的大陸國產重組新冠病毒蛋白疫苗,適用於預防新型冠狀病毒感染所致的疾病(COVID-19)。
大陸國家藥監局根據《疫苗管理法》、《藥品管理法》相關規定,按照藥品特別審批程序,進行應急審評審批,附條件批准該疫苗上市註冊申請。大陸國家藥監局要求該疫苗上市許可持有人繼續開展相關研究工作,完成附條件的要求,及時提交後續研究結果。
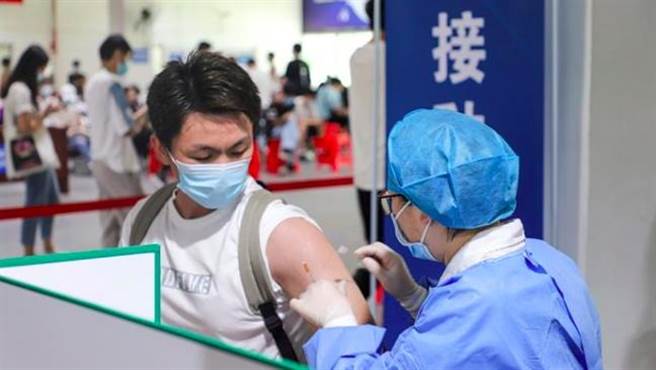
據大陸國家藥監局網站消息,昨天(3月1日)大陸國家藥品監督管理局附條件批准安徽智飛龍科馬生物製藥有限公司的重組新型冠狀病毒蛋白疫苗(CHO細胞)上市註冊申請。該疫苗是首個獲批的大陸國產重組新冠病毒蛋白疫苗,適用於預防新型冠狀病毒感染所致的疾病(COVID-19)。
大陸國家藥監局根據《疫苗管理法》、《藥品管理法》相關規定,按照藥品特別審批程序,進行應急審評審批,附條件批准該疫苗上市註冊申請。大陸國家藥監局要求該疫苗上市許可持有人繼續開展相關研究工作,完成附條件的要求,及時提交後續研究結果。
發表意見
中時新聞網對留言系統使用者發布的文字、圖片或檔案保有片面修改或移除的權利。當使用者使用本網站留言服務時,表示已詳細閱讀並完全了解,且同意配合下述規定:
違反上述規定者,中時新聞網有權刪除留言,或者直接封鎖帳號!請使用者在發言前,務必先閱讀留言板規則,謝謝配合。