搜尋結果
以下是含有孤兒藥的搜尋結果,共147筆
-
益安、台寶、三鼎 搶灘美國
不讓新藥業專美於前,再生醫療與創新醫材10月亦報佳音,益安(6499)、台寶(6892)、三鼎(6808)搶灘美國市場,法人指出,除了產品商業化外,加速跨國臨床合作與海外設廠已成趨勢。
-
《生醫股》藥華藥Ropeg申請美國ET藥證 力拚2026取證
藥華藥(6446)今(31)日宣布,正式向美國食品及藥物管理局(FDA)申請新藥Ropeginterferon alfa-2b-njft(簡稱Ropeg,即P1101)新增適應症,新增適應症為原發性血小板過多症(ET),預計2026年取證,搶攻美國約15萬ET病患市場,並將成為公司第二成長引擎。
-
《生醫股》國邑*L608登美國風濕學會 首款居家治療SSc-DU新藥亮相
國邑*(6875)自主開發的吸入新藥L608(微脂體-伊洛前列素)在2025年美國風濕學會年會(ACR 2025)上發表一期臨床試驗成果。本次數據不僅佐證了L608具備良好的安全性和耐受性,更重要的是,在關鍵的藥物動力學(PK)指標上展現出突破性優勢,為美國尚無核准療法的系統性硬化症相關肢端潰瘍(SSc-DU)市場開啟先發契機。
-
《興櫃股》安基生技甘迺迪氏症新藥AJ201 獲美FDA快速審查認定
安基生技(7754)治療甘迺迪氏症/脊髓延髓性肌肉萎縮症(Kennedy’s Disease 亦稱Spinal and Bulbar Muscular Atrophy, SBMA)的AJ201,獲美國食品藥物管理局(FDA)授予快速審查認定。
-
安基罕病新藥AJ201 獲美國FDA授予快速審查認定
安基(7754)22日公告,旗下治療甘迺迪氏症/脊髓延髓性肌肉萎縮症(SBMA)的AJ201,獲美國FDA授予快速審查認定(Fast Track Designation, FTD)。該新藥先前已獲FDA與歐洲盟EMA孤兒藥認定(Orphan Drug Designations, ODD)。
-
華安泡泡龍新藥申請美國二期臨床 攻24億美元商機
華安(6657)22日公告,自主開發的遺傳性表皮分解性水皰症(Epidermolysis Bullosa, EB,俗稱「泡泡龍」)乳膏新藥F703EB,向美國FDA提交二期臨床試驗申請。由於EB目前尚無根本療法,F703EB挾卓越的機轉優勢,可望作為泡泡龍患者加速傷口癒合的第一線藥物,搶攻全球24億美元的罕病藥物商機。
-
《生醫股》華安泡泡龍新藥 申請美國二期臨床
華安(6657)今(22)日公告,自主開發的遺傳性表皮分解性水皰症(Epidermolysis Bullosa, EB,俗稱泡泡龍)乳膏新藥F703EB,向美國食品藥物管理局(FDA)提交二期臨床試驗申請。由於EB目前尚無根本療法,F703EB挾卓越的機轉優勢,可望作為泡泡龍患者加速傷口癒合的第一線藥物,搶攻全球24億美元的罕病藥物商機。
-
安成生技憂鬱症新藥 送件FDA
安成生技(6610)旗下口服前驅藥物新藥NORA520用於治療產後憂鬱症(PPD)及重度憂鬱症(MDD),於9月與美國FDA完成Type C會議,並於10月16日接獲官方會議紀錄。FDA同意若第二期臨床結果符合預期,可作為樞紐試驗送件,顯示該藥臨床開發邁入關鍵階段。
-
安基新藥AJ201登上世界肌肉學會年會 脊髓延髓肌肉萎縮症治療現曙光
安基生技(7754)13日表示,旗下治療脊髓延髓肌肉萎縮症(SBMA,又稱甘迺迪氏症)的創新療法AJ201,於世界肌肉學會(World Muscle Society, WMS)會中發表轉譯醫學與臨床試驗最新成果,並以臨床二期試驗(Phase 2a)結果入選為今年僅有的七項「最新臨床突破研究」(Late-Breaking Oral Abstract)之一,獲邀進行口頭報告,成為全場焦點。
-
視航生醫乾眼症眼藥水 邁大步
視航生物醫學(7759)日前公告該公司SHJ002眼藥水用於乾眼症治療,三期臨床試驗已完成美國FDA的人體臨床試驗審查申請(IND申請)送件,預計於2026年展開試驗收案。
-
安成生技 明年迎授權金高峰期
安成生技(6610)受惠產後憂鬱症口服新藥NORA520,將於第四季公布二期解盲數據,而治療單純型表皮分解性水皰症(EBS)軟膏新藥AC-203,也規畫明年第一季進行2/3期中分析,安成生技董事長吳怡君指出,二新藥陸續見成果,將帶動公司明年進入授權金高峰期。
-
首家日本生技股在台掛牌 瑞格拚明年上半年登興櫃
首家日本生技股在台掛牌!瑞格拚明年上半年登錄興櫃,營運長楊思聖22日表示,旗下用於GvHD(移植物抗宿主病)免疫調節新藥RGI-2001,已在美國七家頂尖醫學中心完成人體臨床二期(Phase IIb)試驗,2026年可望正式啟動三期臨床試驗。該新藥二b期試驗成果已正式刊登於國際血液學頂尖期刊《Blood》。
-
《產業》瑞格新藥RGI-2001 2b期臨床成果刊登Blood期刊
開發免疫性疾病和癌症新型療法的瑞格國際生技宣布,創新免疫調節新藥RGI-2001已在美國七家頂尖醫學中心完成臨床2b期試驗,並於早期的1/2a期試驗展現優異的安全性與初步療效。
-
《興櫃股》仁新斯特格LBS-008試驗完成 Q4公布DRAGON結果
仁新(6696)子公司Belite宣布完成旗下LBS-008(Tinlarebant)口服新藥針對青少年斯特格病變(STGD1)關鍵臨床三期試驗DRAGON,最後一位受試者已完成最後訪視,Belite預計於2025年第4季公布DRAGON頂線數據結果(Top-line results),並規劃於2026年上半年提交新藥查驗登記申請(NDA)。
-
昱展 新藥拓市報捷
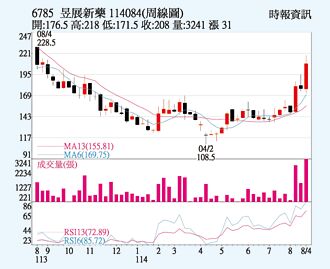
昱展(6785)受惠授權夥伴Indivior將資源聚焦在戒毒癮藥物NDV-60001(ALA-1000),已在10個收案中心啟動多重劑量藥物動力學的收案,明年正式啟動三期臨床試驗,8月以來吸引買盤進駐,22日以208元作收,上漲3.48%,成交量1,106張。技術面均線、KD指標均為多頭排列,後市有利。
-
《生醫股》共信-KY新藥布局加速 PTS302打入中國200家醫院
共信-KY(6617)今(30)日召開法說會,總經理林懋元指出,下半年營運將聚焦兩大主軸:一是持續擴大旗下新藥PTS302在中國市場的市佔率,二是加速推動全球取證佈局。此外,公司也積極推進臨床試驗中新藥,當中用於治療惡性犬類黑色素瘤的新藥,預計最快第三季可望取得台灣藥證,將成為公司首度跨足寵物癌症藥物領域的重要里程碑。
-
新旭用APN-1607 打造早篩利器
國內藥廠也迎頭趕上失智症檢測和新藥開發,其中主打神經退化性疾病精準診斷的新旭生醫(APN LifeSciences),獲得雅詩蘭黛家族創立的「阿茲海默症藥物開發基金會(ADDF)」策略性投資,其正子造影顯影劑「18F-APN-1607 (Florzolotau[18FJ])」可追蹤腦部Tau蛋白病變,以精準診斷阿茲海默症及進行性核上性麻痺(PSP)等Tau蛋白相關的疾病,該產品已在全球收案超過4,000例,建立大規模臨床影像資料庫,並啟動全球多中心臨床試驗,包括美國阿茲海默症臨床二期以及獲得美國食品藥物管理局(FDA)「孤兒藥與快速通道認定(Orphan Drug and Fast Track Designations)」之PSP行動障礙診斷臨床三期。
-
新旭生醫 獲ADDF策略性投資
台灣生技研發能量被世界看見。新旭生醫宣布,獲得「阿茲海默症藥物發展基金會(ADDF)」的策略性投資。ADDF是由美妝巨頭雅詩蘭黛家族創立,該投資將加速新旭APN 1607的開發。
-
《興櫃股》因華生技口服膽道癌孤兒新藥 啟動全球三期臨床試驗
因華生技(4172)宣布開發口服膽道癌孤兒新藥 D07001-Softgel正式進入全球第三期關鍵性臨床試驗,並與美國知名CRO(臨床研究機構)攜手合作,該CRO將執行美國FDA藥證申請的全球臨床試驗,預計收案約240名受試者,力拼2025年底美國試驗地區,首位受試者入組,2026年底可收完期中解盲病人數。
-
《產業》麗寶新藥攜手陽明交大 運用AI技術加速抗癌藥開發
麗寶新藥與國立陽明交通大學今(1)日簽署產學合作備忘錄(MOU),共同啟動「人工智慧導向之新藥開發計畫」。麗寶新藥總經理劉朝瀚(Dr. Henry Liu)表示,這次雙方強強聯手,目標將AI運用在臨床藥物開發上,以縮短試驗時程並提升藥物測試的效率與準確度,同時也加速藥證的取得。