
欧盟医疗器材新法规(MDR)2028年底全面上路,现阶段台厂仅佳世达、安克、大医、联合、豪展、雃博、视阳等16家厂商取得许可证,拿到进入欧盟市场的门票;而过去核发的MDD旧证,针对侵入性的中高风险品项,效期已于去年底到期,厂商前进欧盟市场面临严峻考验。
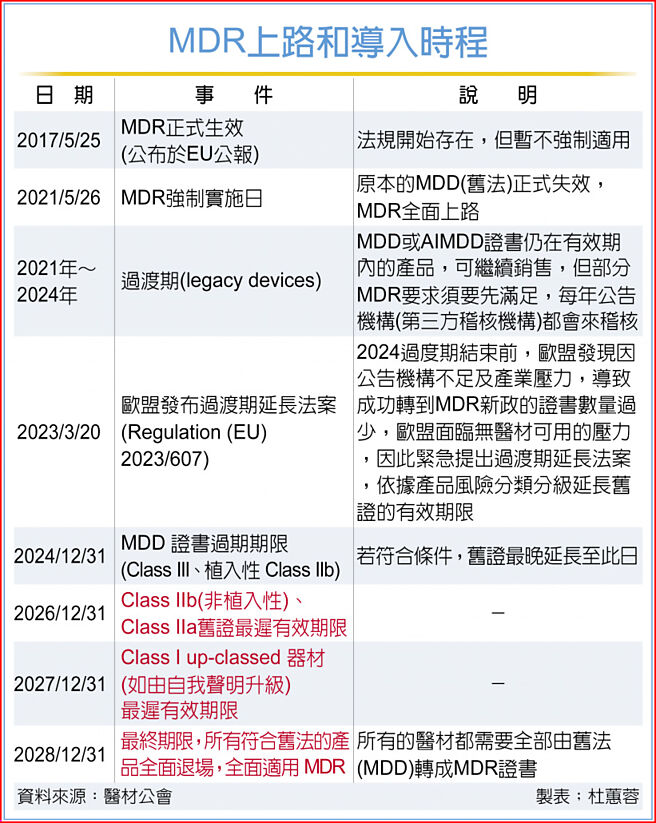
MDR法规是在2017年5月公布,原本规画是2021年MDD(旧法)失效后,MDR全面上路,2021~2024年为过渡期;惟期间因机构不足及产业压力,导致成功转到MDR新政证书数量过少,欧盟面临无医材可用的压力,紧急提出过渡期延长法案,依据产品风险分类分级延长旧证的有效期限。
目前已确定MDR将在2028年底全面上路,高风险的Class III和植入性中高风险的Class IIb等级产品的旧证已于去年底到期,未来台湾医材业者欲前进欧盟须有MDR认证才能拿到入门票。
医材公会理事长李永川表示,MDR法规虽是挑战,但也是台湾医材产业升级与迈向国际市场的重要契机,为加速厂商布局欧盟,公会正积极推动相关专案,协助业者提升国际竞争力。
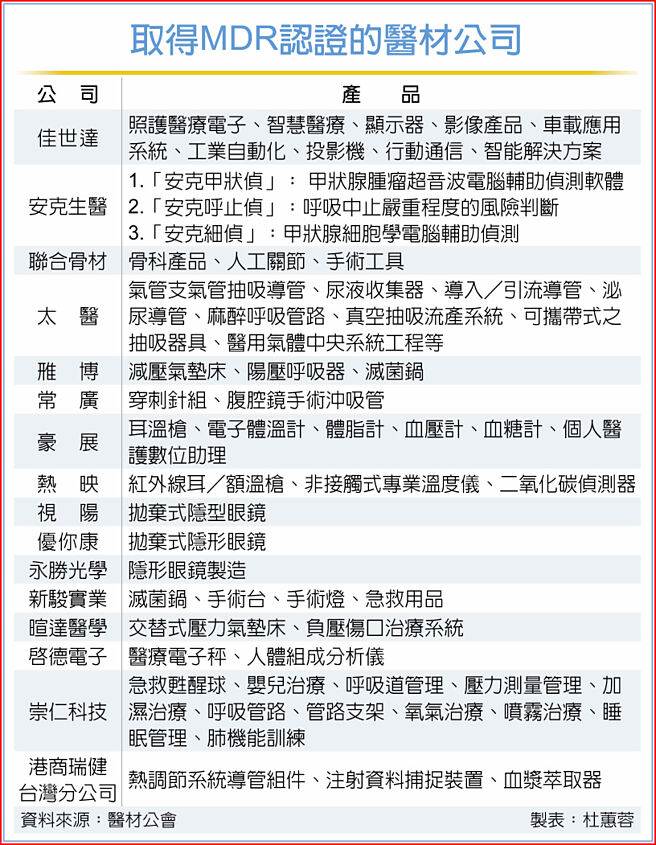
就医材公会统计,目前仅有佳世达、安克生医、联合骨材、太医、雃博、常广、豪展、热映、视阳、优你康、永胜光学、新骏实业、暄达医学、启德电子、崇仁科技、港商瑞健台湾分公司等16家厂商取得MDR认证。
医材公会法遵临床组长邱子熏说,台湾外销欧盟占比近15%,集中在德、英、荷、义,四国相加占比约12%;目前在欧盟登记要贩售产品的医材厂商共385家(包含Class I)。有鑑于MDR法规的全面上路,除已有约16家厂商成功取得欧盟产品许可证外,预期数量会持续攀升。
李永川说,欧盟MDR法规不仅是一项合规要求,更象徵监管思维的转型,强调病人安全、资讯透明与产品全生命周期的可追溯性。对制造商而言,取得MDR认证已成为进军欧洲市场的重要门槛,从风险评估、品质管理到上市后监测,都需展现对法规要求的高度理解与落实能力。

发表意见
中时新闻网对留言系统使用者发布的文字、图片或檔案保有片面修改或移除的权利。当使用者使用本网站留言服务时,表示已详细阅读并完全了解,且同意配合下述规定:
违反上述规定者,中时新闻网有权删除留言,或者直接封锁帐号!请使用者在发言前,务必先阅读留言板规则,谢谢配合。