搜尋結果
以下是含有臨床三期試驗的搜尋結果,共66筆
-
《生醫股》國邑長效吸入新藥L606三期報喜 將加快進入千億市場
國邑*(6875)今(4)日下午舉行法說會,獨家開發並授權美國Liquidia(LQDA)的長效吸入新藥L606臨床三期,展現穩定藥效與極低副作用。在取證策略上,美國FDA與歐洲EMA已同意L606未來僅需完成一項PH-ILD全球三期臨床試驗(RESPIRE),即可同時支持PAH與 PH-ILD雙適應症在美國與歐洲的上市申請(NDA/MAA)。這將大幅提升開發效率並擴大未來市場覆蓋,加速全球上市佈局。
-
《興櫃股》仁新獲英核准以LBS-008期中分析 提交條件式上市許可申請
仁新(6696)子公司Belite Bio, Inc(那斯達克股票交易代碼:BLTE,以下簡稱Belite)宣布,英國藥品與醫療產品監管署(MHRA)同意基於LBS-008(Tinlarebant)治療青少年斯特格病變(STGD1)臨床三期試驗DRAGON之期中分析結果,Belite可提交STGD1條件式上市許可(Conditional Marketing Authorization, CMA)申請。
-
順藥中風新藥 明年拚三期臨床
晟德集團旗下順藥(6535)法說會公布急性缺血性中風新藥LT3001臨床二期結果,然法人認為缺乏統計顯著性(p值<0.05)、多國試驗提前終止樣本數過少、三期臨床規模龐大成本與時間壓力高、授權時間不明等四大理由「打臉」,讓順藥後市股價和三期臨床設計備感壓力。
-
《生醫股》新藥數據未獲認同 順藥一度跌停
晟德集團旗下新藥研發公司順藥(6535)昨(27)日再度說明創新中風治療新藥LT3001中國大陸二期臨床數據及多國多中心二期試驗結果,沒想到,市場仍舊不買單,今(28)股價跳空開低,盤中曾一度跌停板,隨後雖然打開,但跌幅仍逼近9%。
-
《生醫股》太景流感新藥獲中國核准 啟動小兒臨床三期試驗
新藥研發公司太景*-KY(4157)接獲中國大陸合作夥伴健康元藥業集團通知,流感抗病毒新藥Pixavir marboxil(TG-1000)小兒劑型已通過國家藥品監督管理局(NMPA)藥品審評中心(CDE)審查,可免除臨床二期試驗,直接開展三期臨床試驗,進行療效及安全性試驗。
-
太景流感新藥獲准大陸啟動小兒臨床三期試驗
太景*-KY(4157)公告,接獲中國大陸合作夥伴健康元藥業集團通知,流感抗病毒新藥Pixavir marboxil (TG-1000)小兒劑型已通過國家藥品監督管理局(NMPA)藥品審評中心(CDE)審查,可免除臨床二期試驗,直接開展三期臨床試驗,進行療效及安全性試驗。
-
《興櫃股》安基生技甘迺迪氏症新藥AJ201 獲美FDA快速審查認定
安基生技(7754)治療甘迺迪氏症/脊髓延髓性肌肉萎縮症(Kennedy’s Disease 亦稱Spinal and Bulbar Muscular Atrophy, SBMA)的AJ201,獲美國食品藥物管理局(FDA)授予快速審查認定。
-
安基罕病新藥AJ201 獲美國FDA授予快速審查認定
安基(7754)22日公告,旗下治療甘迺迪氏症/脊髓延髓性肌肉萎縮症(SBMA)的AJ201,獲美國FDA授予快速審查認定(Fast Track Designation, FTD)。該新藥先前已獲FDA與歐洲盟EMA孤兒藥認定(Orphan Drug Designations, ODD)。
-
興櫃三悍將 周漲逾3成
台股本周在押寶台積法說行情帶動下,高點衝上27,732點,再創歷史新高紀錄,除了電子權值股領軍外、傳產股也各有表現,興櫃市場呈現個股輪動表態,仁新(6696)本周以上漲30.7%躍居漲幅冠軍,芝普(7858)、智新生技*(7832)也分別大漲30.69%、30.09%,排名第二、三名。
-
《熱門族群》國邑、生華科雙雙登頂 生技多頭人氣狂按讚
國邑*(6875)新藥L606臨床三期試驗的完整報告即將在月底公布、生華科(6492)獲Google AI點名新藥將開啟冷腫瘤免疫治療新契機,今(17)日股價雙雙飆上漲停板53.9、43.9元鎖住,成為生技族群的領頭羊,也維繫住多頭人氣。
-
《興櫃股》仁新子公司Belite斯特格病變新藥獲NMPA優先審評資格
仁新(6696)子公司Belite獲中國大陸NMPA同意以LBS-008 Dragon期中分析結果提交新藥查驗登記申請(NDA)並授予優先審評,今(16)日股價聞聲大漲,盤中一度衝上267元,漲幅在12%以上。
-
《興櫃股》圓祥生技申請科技事業許可 加速推進新藥研發與策略布局
圓祥生技(6945)營運發展與新藥研發布局上邁出關鍵一步,近日已向主管機關提交科技事業許可函申請。
-
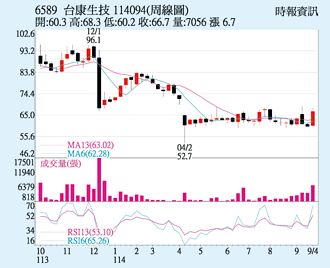
台康生 新藥開發利多
台康生(6589)受惠乳癌生物相似藥EG1206A,獲美國FDA及歐盟EMA同意豁免進行臨床三期試驗,將可直接加速推進該產品的全球上市許可申請(BLA/MAA),26日逆勢上漲6.04%,以66.7元創下近二個月波段新高,成交量放大至4,216張,技術面翻多,外資連二買,有利多頭。
-
《生醫股》省經費+時間 台康乳癌生物相似藥豁免進行臨床三期試驗
台康生技(6589)與美國食品藥物管理局(FDA)及歐盟藥品管理局(EMA)進行科學諮詢正在進行開發乳癌生物相似藥產品EG1206A(Pertuzumab biosimilar)三期臨床試驗豁免得到正面回應,也正式終止EG1206A的三期臨床試驗。這項豁免臨床三期試驗成果,台康將加速送審資料準備,產品進入市場的時間也會縮短。
-
《興櫃股》仁新斯特格LBS-008試驗完成 Q4公布DRAGON結果
仁新(6696)子公司Belite宣布完成旗下LBS-008(Tinlarebant)口服新藥針對青少年斯特格病變(STGD1)關鍵臨床三期試驗DRAGON,最後一位受試者已完成最後訪視,Belite預計於2025年第4季公布DRAGON頂線數據結果(Top-line results),並規劃於2026年上半年提交新藥查驗登記申請(NDA)。
-
國邑*夥伴LQDA 推進L606開發
國邑*(6875)合作夥伴Liquidia(LQDA)受邀出席2025年富國銀行年度醫療保健會議,大篇幅介紹新一代吸入型治療藥物L606的臨床最新進展、全球競爭優勢及市場核心定位,積極規畫L606上市開發工作。
-
「隱形股王」康霈落難終結?外資力挺連2買 早盤巨震飆7%
才剛躋身台灣50成份股的康霈 *(6919),還等不到成份股身分在9月22日正式生效,就因在法說會中提及減肥新藥 CBL-514 臨床三期試驗將延後半年,將法說會開成法會。被逼吞二根跌停後,今日股價終於回神,不但由黑翻紅,還一度衝高至222.5元、漲幅7.49%,惟衝高僅有曇花一現,隨後就壓回平盤附近做整理,顯示仍有浮額待清洗。
-
技轉吸金潮 生技業營運添柴火
不讓藥證股專美於前,生技業第三季技轉授權與資金挹注消息也頻傳,藥華藥接連取得生技中心(DCB)與工研院創新抗體藥物的獨家授權;仁新醫藥小金雞Belite亦再獲國際大型基金1,500萬美元投資。
-
《生醫股》富國銀行醫療保健會議 國邑*合作夥伴說明L606進度
國邑*(6875)合作夥伴Liquidia(LQDA)近期受邀出席2025年富國銀行(Wells Fargo)第20屆年度醫療保健會議,其中以大篇幅介紹新一代吸入型治療藥物L606的臨床最新進展、全球競爭優勢及市場的核心定位。
-
隱形股王殺第2根跌停!委賣飆破3萬張 爆內部人連3月賣股
生技股康霈*因研發減重藥的臨床三期試驗延後,引發投資人疑慮,股價連續兩個交易日跌停。今(11日)開盤再度跌停,目前委賣張數飆破3萬張,股價下探至207元。