罕病新药卡位投资热潮,在安基生技治疗甘迺迪氏症小分子新药AJ201,以2.5亿美元(约合新台币逾75亿元)授权美国Avenue,引为话题,而国内至少12家厂商开发的罕病新药已取得孤儿药资格下,能否再接棒授权或引爆研发风潮,也成市场关注焦点。
罕见疾病在美国的定义是指20万人以下的疾病,或罹病率千分之0.65到1的疾病。全球已知有7,000种罕病,影响3.5亿人,但只有200种疾病有核准的药物治疗方式。
有鑑于罕病市场缺口太太,为了加速药物上市,美国和欧盟都祭出孤儿药的优惠政策,除了可享有试验费用50%税额扣抵、上市规费豁免和新药上市后七~十年的独卖期外,罕病新药也因市场竞争产品少,开发成功机率高,加上药价高、毛利率高达80%以上,近年吸引国际大厂纷纷以併购或授权方式抢进。
投资专家谷月涵曾公开表示,台湾制药业有竞争力,市值、投资和上市柜比例都高于韩国、日本、印度等国,二期研发的新药和孤儿药都很受关注。
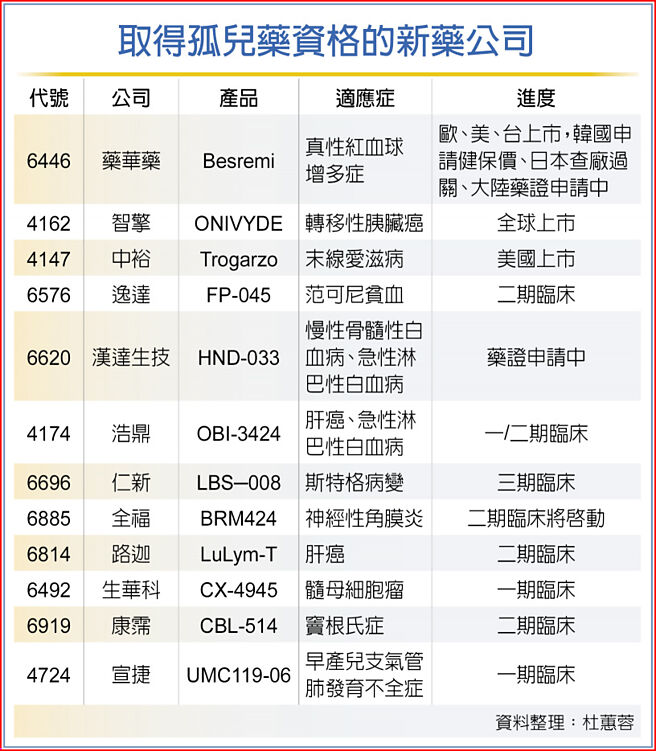
国内目前新药公司偏向以新剂型新药和罕病新药为重心,初步统计,药华药、智擎、中裕、逸达、汉达、浩鼎、仁新、全福、路迦、生华科、康霈和宣捷等12家公司旗下新药已取得孤儿药资格。
其中,药华药治疗真性红血球增多症、智擎的胰臟癌新药已授权,并已顺利在全球上市销售。
中裕治疗末线爱滋病新药Trogarzo,则已拿到静点滴(IV)剂型和静脉推注剂型药证,而最受关注的肌肉注射(IM)剂型,则有机会在2023上半年申请sBLA上市核准。
汉达已经取得慢性骨髓性白血病、急性淋巴性白血病两个孤儿药认证,享有七年专卖权,该新药已于去年9月提交新药药证申请,已经拿到商品名,预计上半年美国FDA会给出药证的最终结果。
仁新治疗斯特格病变新药已分别取得美国、欧盟孤儿药认证(ODD),美国更拿到儿科罕见疾病认证(RPD),目前也获得在英国、香港核准进行三期临床,法人看好有机会争取循快速通道或加速核准等方式,加快药物临床与上市时程。
发表意见
中时新闻网对留言系统使用者发布的文字、图片或檔案保有片面修改或移除的权利。当使用者使用本网站留言服务时,表示已详细阅读并完全了解,且同意配合下述规定:
违反上述规定者,中时新闻网有权删除留言,或者直接封锁帐号!请使用者在发言前,务必先阅读留言板规则,谢谢配合。