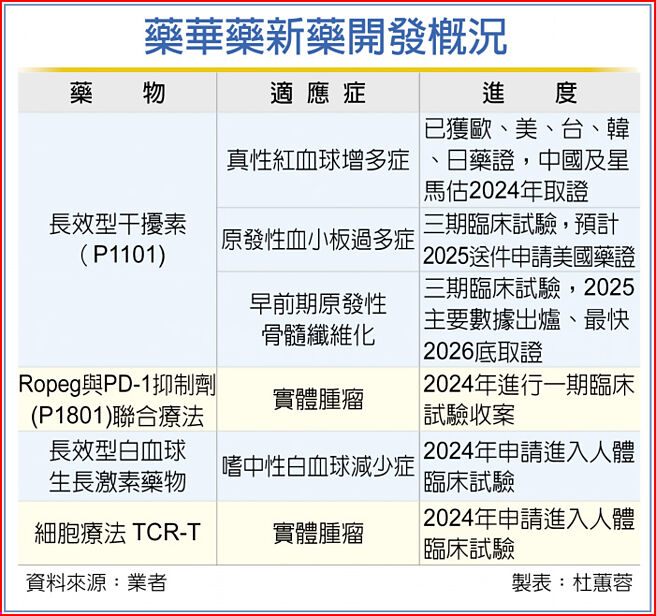
藥華藥(6446)新藥開發火力全開!除了用於真性紅血球增多症的BESREMI(P1101)年中可望取得中國大陸、星馬藥證外,也將啟動早期骨髓纖維化三期臨床試驗,加上跨足細胞治療等全新領域。藥華藥執行長林國鐘表示,2024年不一定會賺很多錢,但一定會賺錢。
將於25日轉上市的藥華藥,23日舉行法說會。林國鐘表示,2024年營收成長強勁,藥證和新藥臨床大有進展;而全球供應鏈進度也符合預期,台中廠產線擴充後,可供應全球最少1萬人。竹北廠則預計2025年完工,2026年取證、投產。另外,也預計擴充PEG廠及針劑充填廠規模,因應藥品持續成長的需求。
藥華藥董事長詹青柳表示,藥華藥主力產品BESREMI,已獲得美國、歐洲及日本等地藥證,最受期待的中國藥證,按照進度有機會在6、7月取得,成為中國官方核准的第一個用於真性紅血球增多症(PV)藥品。而新加坡及馬來西亞的PV藥證,亦有機會在2024年拿下,前進東協市場,目前內部正積極規劃行銷。
另外,P1101用於原發性血小板過多症(ET)的全球第三期臨床試驗已於2023年10月完成收案,預計2024年底到2025年初可完成主要療效指標數據收集後,即申請美國及各國藥證,2025年底到2026年初取證。
用於早前期原發性骨髓纖維化(Early PMF)全球第三期臨床試驗計畫,已於1月17日送件美國FDA,預計收110人,於2025年完成主要療效指標數據收集、最快2026年取證。
除既有產品外,藥華藥積極投入細胞療法,自體細胞治療TCR-T用於實體腫瘤治療,2024年預計也將送件申請一期臨床(IND)。詹青柳表示,該技術平台自外授權引進,大陸合作方已有推進實體腫瘤臨床。目前已規劃,初期將在國家生技園區進行細胞培養,待明年竹北廠落成後,將進行細胞治療商業量產。
為拓展產品線,藥華藥2024年除主力產品可望再取得中國等藥證外,也要啟動早期骨髓纖維化三期臨床試驗。另將跨足細胞治療等全新領域,授權引進的TCR-T細胞治療,申請進入人體臨床試驗(File IND)。

發表意見
中時新聞網對留言系統使用者發布的文字、圖片或檔案保有片面修改或移除的權利。當使用者使用本網站留言服務時,表示已詳細閱讀並完全了解,且同意配合下述規定:
違反上述規定者,中時新聞網有權刪除留言,或者直接封鎖帳號!請使用者在發言前,務必先閱讀留言板規則,謝謝配合。