台灣生技新藥研發歷經20多年發展,近年陸續進入開花結果階段!為了解台灣研發上市新藥進軍國際之階段性成果,本文針對台灣已成功推進國際取證上市之產品,檢視目前主要市場銷售、及新市場與新應用的開發概況,一窺新藥研發之布局路徑。
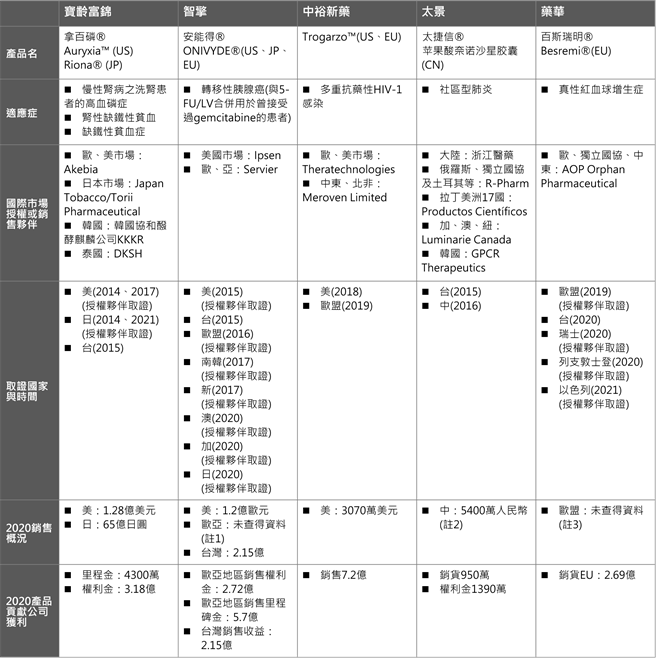
累計我國通過生技新藥產業發展條例審議、完成研發並取得國內藥證之新藥品項共有18項,取得國際上市的則有7項、分別是拿百磷® (Nephoxil®)、安能得 (ONIVYDE®)、Trogarzo™、太捷信® (Taigexyn®)、百斯瑞明® (Besremi®)、美適亞 (Megaxia),以及納疼解® (Naldebain®)。由於Megaxia屬特殊學名藥、另納疼解®則甫於2020年底取得新加坡藥證,未納入本文範疇。
1. 拿百磷® (Nephoxil®、Auryxia™、Riona®)
2001年,寶齡富錦自美國密西根大學取得拿百磷基礎技術的全球專利獨家授權,開始投入新藥研發,2005年完成美、台跨國多中心二期臨床試驗後,與美國那斯達克上市公司Keryx Biopharmaceuticals達成歐、美、日國際授權合作,爾後Keryx於2007年將日本市場轉授權予Japan Tobacco/ Torii Pharmaceutical。
2014年Keryx和Torii Pharmaceutical分別取得美、日藥證,寶齡富錦也在2015年1月取得台灣藥證,適應症為治療慢性腎病洗腎患者之高血磷症。
在新適應症的開發上,2017年Keryx已取得「腎性缺鐵性貧血」擴充適應症的藥證(sNDA),JT-Torii也成功在今年取得缺鐵性貧血症sNDA,寶齡富錦目前亦在台灣進行腎性缺鐵性貧血樞紐三期臨床試驗。此外,前述企業並亦針對延緩慢性腎臟病惡化、抗心血管硬化等適應症陸續取得專利與規劃開展延伸性研究。
2. 安能得® (ONIVYDE®)
2003年,智擎由美國Hermes Biosciences授權引進PEP02歐、亞開發權利,美國開發權利則由Hermes繼續保有,2009年Hermes則被Merrimack Pharmaceuticals併購。2011年初,智擎發表PEP02胰腺癌與胃癌的二期臨床試驗結果,同年5月將歐、亞的開發銷售授權予Merrimack,智擎則保留台灣權利,並收取歐、亞市場開發里程碑金與銷售權利金。
2014 Merrimack將PEP02美國與台灣以外之權利授權給Baxalta、2017 則又將美國權利賣給法國Ipsen公司;其中Baxalta在2016年被Shire併購,2018 Shire則將癌症事業體賣給法國Servier,最後Servier擁有美國與台灣外之所有區域之權利。自2015年開始,在前述企業推展下,ONIVYDE陸續在美國、台灣、歐洲、韓國、日本等40多個國家上市,用於胰腺癌病人在接受過標準藥物gemcitabine失敗後的治療。
新市場的部分,Ipsen已提出中國藥證申請,目前審查進行中;至於新適應證,則有胰腺癌第一線用藥及小細胞肺癌二線用藥,皆已進入三期臨床試驗,持續拓展市場規模。
3. Trogarzo™
中裕新藥2007年自美國Genentech取得Ibalizumab (研發代號TMB-355)全球市場獨家授權後,於2011年完成臨床二期試驗。美國FDA在2014年給予TMB-355應用於多重抗藥性HIV-1感染病人之孤兒藥資格,並於2015年,給予突破性治療資格(breakthrough therapy)。
2016年中裕完成臨床三期樞紐性試驗,接續兩年並與加拿大Theratechnologies公司簽訂美國/加拿大地區、以及歐洲地區獨家銷售行銷契約。TMB-355最終於2018、2019年分別取得美國、歐盟藥證,適應症為多重抗藥性HIV-1感染,並以Trogarzo™正式開啟市場銷售。
除美國與歐洲市場交由Theratechnologies負責銷售外,在海外新市場的開發上,2019並和愛爾蘭商Meroven Limited簽訂的10年獨家銷售行銷契約,由Meroven推進中東及北非地區的取證與銷售。
為擴大使用者族群,中裕已在美國推進TMB355併用其他愛滋病藥物的臨床試驗;此外,為提高藥物使用方便性,中裕目前已完成靜脈推注(IV Push)臨床試驗,加拿大夥伴Theratechnologies亦開展肌肉注射三期臨床試驗。
4. 太捷信® (Taigexyn®)
太景2004年自寶鹼(P&G)醫藥部門取得開發奈諾沙星的權利,從臨床Ia期後接手研發。2009 P&G醫藥部門併入美國Warner Chilcott公司,太景並於2012年依合約自WC公司無償取得全球專利。同年12月完成奈諾沙星口服劑型中國及台灣合併的三期臨床試驗,並授權浙江醫藥負責大陸上市後的生產銷售,爾後太景於2015、2016年分別取得台灣、大陸新藥藥證,適應症為社區型肺炎。
在新市場的開發上,太景並於2014年將俄羅斯、獨立國協及土耳其等區域授權予俄羅斯藥廠R-Pharm,2016年則將拉丁美洲17國區域授權予Productos Científicos,目前進入藥證申請階段;此外,2020年則分別授權加拿大藥品公司Luminarie Canada開發加、澳、紐市場,韓國市場則交由GPCR,累計新市場的授權涵蓋範疇約30餘國。
5. 百斯瑞明® (Besremi®)
2006年,藥華公司以定點PEGylation技術平台投入長效型干擾素的開發,2009年Ropeginterferon alfa-2b(研發代號P1101)進入臨床試驗階段,同年並與奧地利AOP Orphan Pharmaceuticals簽約,將P1101在歐洲、獨立國協以及中東區域,應用於骨髓增殖性腫瘤(myeloproliferative neoplasms MPNs)的商業化權利授權予AOP公司,在歐洲開啟真性紅血球增生症(Polycythemia Vera,PV)的I/II期臨床試驗。
2019年,AOP取得歐盟藥證許可、2020與2021年則分別取得瑞士、以色列等國家藥證。藥華則於2020年取得台灣藥證。
而新適應症開發上,則包括C型肝炎病毒基因型第2型、治療原發性血小板過多症(ET)以及慢性B型肝炎,前兩項新適應症已進入三期臨床試驗,其中C型肝炎病毒基因型第2型已完成台灣、韓國與大陸收案;ET的全球多國多中心第三期臨床試驗,則從2020年開始陸續在美國、台灣、日本、韓國、大陸、新加坡及東歐國家等地收案。
從上述幾項台灣研發新藥上市概況可了解,台灣生醫企業確實已有能力開發出具國際市場價值之新藥,而在20年的發展歷程中,產業不論在研發選題、全球專利布局、到國際臨床試驗與取證法規路徑設計,再到國際授權談判等面向亦已積累完整know-how與實務經驗,同時近年產業在國際合作布局和授權談判策略更是愈見靈活!
包括去年合一研發抗體新藥授權歐洲LEO Pharma,授權金5.3億美元,與國際其他一期臨床試驗階段藥物授權案相比,屬高標授權水準;此外,逸達前列腺癌新藥也成功分別授權美國Intas Pharmaceuticals、中國長春金賽藥業等,累計總授權金亦有3.31億美金!從這些案例可期待台灣生技新藥發展,未來將有更多有競爭力的新藥打入國際盃,並為產業帶來更高價值的研發收益。
發表意見
中時新聞網對留言系統使用者發布的文字、圖片或檔案保有片面修改或移除的權利。當使用者使用本網站留言服務時,表示已詳細閱讀並完全了解,且同意配合下述規定:
違反上述規定者,中時新聞網有權刪除留言,或者直接封鎖帳號!請使用者在發言前,務必先閱讀留言板規則,謝謝配合。